به طور کلی پارامترهای کیفی آب را میتوان به سه دسته فیزیکی، شیمیایی و بیولوژیکی تقسیم بندی کرد. اندازه گیری این پارامترها در طول فرایند تصفیه آب یا سایر فرایندهای صنعتی از اهمیت بالایی برخوردار است زیرا تغییر مقادیر هر کدام از پارامترها بر کیفیت آب تاثیر به سزایی دارد. از مهمترین پارامترهای کیفی آب میتوان به کل جامدات محلول (TDS)، هدایت الکتریکی (EC)، pH، پتاسیل اکسیداسیون کاهش (ORP) و اکسیژن محلول (DO) اشاره داشت. در ادامه توضیحاتی در رابطه با هر کدام از این پارامترها و نحوه اندازه گیری آنها ارائه شده است.
کل جامدات محلول (TDS)
TDS که مخفف Total Dissolved Solid و به معنای کل جامدات محلول میباشد، معیاری از ترکیب مواد آلی و غیرآلی است که در آب حل میشوند. TDS آب را با واحدهای mg/L یا ppm گزارش میکنند. جامدات محلول آب میتوانند شامل نمکها، مواد معدنی، فلزات، کاتیونها یا آنیونها باشند. نمکهای معدنی عمدتا عبارتند از کلسیم، پتاسیم، منیزیم، سدیم، سولفاتها و کلریدها. TDS رابطه مستقیمی با هدایت الکتریکی (EC) دارد، به طوری که با اندازه گیری یکی از آنها میتوان دیگری را با استفاده از فرمول زیر به دست آورد.
TDS (mg/L)= EC (µmho/cm)×(0.55-0.7)

برای اندازه گیری TDS آب از دستگاه TDS متر استفاده میشود. این دستگاهها عمدتا بسیار ساده هستند و کار کردن با آنها نیز آسان میباشد، به طوری که با قرار دادن پراب این دستگاه در داخل آب، مقدار جامدات محلول در آب به صورت mg/L یا ppm در نمایشگر آنها نشان داده میشود. هرچه مقدار عدد گزارش شده بیشتر باشد، بدین معنا است که جامدات محلول (آلودگی) بیشتری در آب حضور دارند و کیفیت آب پایینتر است. مقادیر TDS بالا میتواند بر طعم و بو اثر نامطلوب بگذارد به طوری که باعث شور و یا تلخ شدن طعم آب میشود. سازمان جهانی بهداشت (WHO) جدول زیر را در رابطه مقادیر TDS و کیفیت آب (بر اساس طعم آب) ارایه کرده است. البته باید توجه داشت که بهترین محدوده TDS برای آب آشامیدنی 50 تا 150 میلیگرم بر لیتر میباشد.

هدایت الکتریکی (EC)
هدایت الکتریکی یا EC در واقع توانایی آب برای انتقال جریان الکتریسیته است که با اندازه گیری غلظت مواد محلول موجود در آب به دست میآید. EC عمدتا با واحدهای mS/cm (میلی زیمنس بر سانتیمتر) یا µS/cm (میکروزیمنس بر سانتیمتر) بیان میشود. با توجه به این که یونهای موجود در آب، الکترونها را حمل و جریان الکتریکی را منتقل میکنند، هرچه میزان یونهای موجود در آب بیشتر باشد، EC نیز بیشتر است. هدایت الکتریکی کم آب خالص نیز به دلیل مقادیر کم مواد محلول موجود در آب میباشد. باید اشاره داشت که یونهای معدنی مانند کلریدها، قلیاها، کربناتها و نمکهای محلول نقش اصلی را در انتقال جریان الکتریکی به عهده دارند. فلزات نیز به دلیل داشتن تعداد زیادی الکترون آزاد، به افزایش EC کمک میکنند. همچنین باید توجه داشت که هدایت الکتریکی به دما وابسته است و تغییرات دما باعث تغییر در مقدار EC میشود.
رسانایی الکتریکی یا EC را میتوان به سادگی و با استفاده از ECمتر اندازه گیری کرد. این دستگاه از دو الکترود فلزی که به فاصله یک سانتیمتر از یک دیگر قرار دارند، تشکیل شده است (به همین علت است که واحد اندازه گیری EC میلیزیمنس یا میکروزیمنس بر سانتی متر میباشد). با برقراری ولتاژ ثابت در دو سر الکترودها، جریان الکتریکی از درون محلول عبور میکند. با توجه به این که میزان عبور جریان الکتریکی درون آب متناسب با غلظت یونهای محلول آب است، هدایت الکتریکی اندازه گیری و بر روی صفحه نمایش دیجیتالی دستگاه نشان داده میشود. هنگام کار با ECمتر برای دستیابی به دقت بالا باید به نکاتی مانند ثابت بودن دما، تمیز بودن سلول اندازه گیری و غوطه ور شدن کامل الکترودها در محلول توجه داشت.

pH
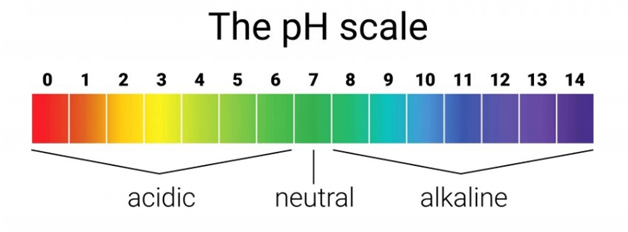
pH در اصل مقدار لگاریتمی از غلظت یونهای هیدروژن یک محلول آبی است که توسط رابطه pH=-log[H+] محاسبه میشود. pH به زبان ساده پارامتری است که میزان اسیدی یا قلیایی بودن یک محلول را نشان میدهد. این پارامتر در محدوده 0 تا 14 متغیر میباشد. pH برابر 7 حالت خنثی است و آب خالص نیز pHاش برابر 7 میباشد. pHهای کمتر از 7 دارای خاصیت اسیدی و pHهای بیشتر از 7 دارای خاصیت بازی یا قلیایی هستند. باید توجه داشت که pH یک مقیاس لگاریتمی است و بدین معنا میباشد که هر یک واحد تغییر در pH نشان دهنده یک تغییر 10 برابری در اسیدیته است. برای مثال، آبی با pH=5 به میزان 10 برابر از آبی با pH=6 اسیدیتر میباشد. مطابق pH ،EPA جزو استانداردهای ثانویه آب محسوب میشود و مقدار مناسب آن بین 6.5 تا 8.5 است. آبهایی با pH بیش از حد بالا و پایین برای استفاده مناسب نیستند زیرا در pHهای بالا طعم آب تلخ میشود و امکان گرفتگی لولهها با رسوبات وجود دارد. همچنین pH بالا اثر ضدعفونی با کلر را کاهش میدهد و باعث افزایش مصرف کلر برای رسیدن به سطح خاصی از ضدعفونی میشود. pH پایین نیز منجر خوردگی یا حل شدن فلزات و سایر مواد در آب میگردد.
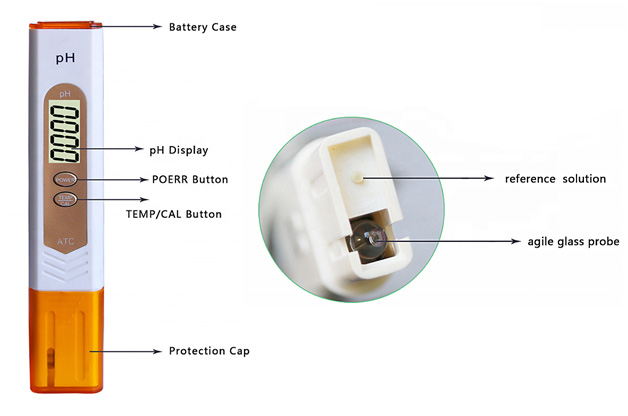
برای اندازه گیری pH میتوان از روش فتومتریک (photometric) یا پتانسیومتریک (potentiometric) استفاده کرد. روش فتومتریک یا بصری به معنای استفاده از کاغذ تورنسل یا کاغذ pH است. این کاغذها با قرارگیری در معرض محلولهایی با pHهای مختلف، رنگهای به خصوصی را از خود نشان میدهند. این روش، دقت بالایی ندارد و برای اندازهگیریهای سریع و ارزان قیمت به کار برده میشود. روش پتانسیومتری، روشی است که در آن از یک pHمتر که دارای یک الکترود حساس به pH است، استفاده میشود. در pHمترها با استفاده از اندازه گیری پتانسیل الکتریکی الکترود، pH اندازه گیری میشود و بر روی صفحه نمایش دستگاه نشان داده میشود. با توجه به حساسیت بالای الکترودها، pHمترها بسیار دقیق هستند و تقریبا برای هر کاربردی قابل استفاده میباشند.

یک pH متر اساسا از یک ولت متر متصل به یک الکترود حساس به pH و یک الکترود رفرنس یا مرجع (غیر متغیر) تشکیل شده است. الکترود حساس به pH عمدتا شیشهای است و الکترود رفرنس نیز عمدتا جیوه-جیوه کلرید (کالومل) میباشد (الکترود رفرنس نقره-نقره کلرید نیز مرسوم است). هنگامی که دو الکترود درون محلول غوطه ور میشوند، همانند یک باتری عمل میکنند. الکترود شیشهای، یک پتانسیل الکتریکی (بار) ایجاد میکند که به طور مستقیم با فعالیت یون هیدروژن در محلول متناسب است. ولت متر نیز اختلاف پتانسیل بین الکترود شیشه و رفرنس را اندازه گیری میکند. در نتیجه مقدار pH محلول در صفحه نمایش و یا به صورت آنالوگ توسط مقیاس و سوزن منحرف شده، نمایش داده میشود.
پتانسیل اکسیداسیون کاهش (ORP)
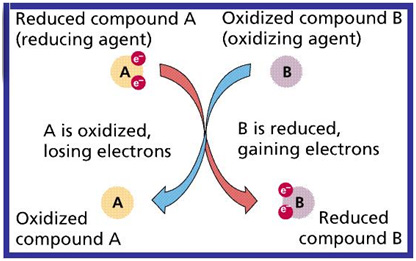
پتانسیل اکسیداسیون کاهش یا همان ORP (Oxidation Reduction Potential) در واقع معیاری از ظرفیت محلول برای انتقال الکترون (اکسیداسیون یا کاهش) است. ORP با نام دیگر Redox که مخفف Reduction Oxidation است نیز شناخته میشود و بیانگر این میباشد که در یک واکنش شیمیایی، اکسیداسیون و کاهش مکمل یکدیگر هستند و به تنهایی رخ نمیدهند؛ به عبارت دیگر اگر یک گونه تحت اکسیداسیون قرار گیرد (الکترون از دست بدهد)؛ گونه دیگر باید آن الکترونها را بپذیرد و کاهش یابد. مقدار ORP را با میلیولت (mV) اندازه میگیرند و این مقدار میتواند مثبت یا منفی باشد. ORP مثبت بیانگر اکسیدکننده بودن ماده و ORP منفی به معنی کاهنده بودن ماده است. محدوده کلی ORP نیز عموما بین 1500- تا 1500+ میلیولت میباشد و مقدار ORP صفر نیز بیانگر حالت خنثی است.
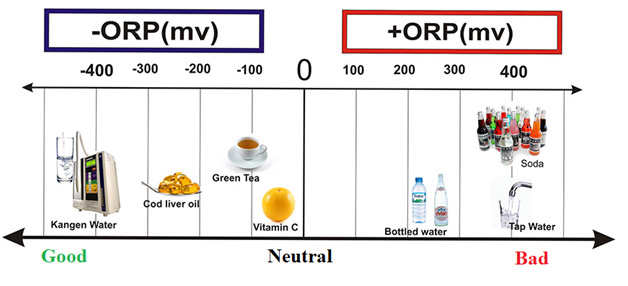
به طورکلی اکسیداسیون (Oxidation) به معنای از دست دادن الکترون است و در صورتی که مادهای اکسید شود، الکترونهایش را به مادهای دیگر میدهد؛ بنابراین اکسید کنندهها الکترونهای مولکولهای دیگر را میگیرند و مقدار ORP آنها مثبت است. کاهش (Reduction) نیز به معنای افزایش الکترونها میباشد و مادهای که کاهش مییابد، الکترون به دست میآورد؛ از این رو، مادهای که الکترونهایش را به ماده دیگر اهدا میکند، عامل کاهنده یا آنتی اکسیدان نامیده میشود؛ مقدار ORP کاهندهها نیز منفی است. باید توجه داشت که هرچه مقدار ORP بیشتر باشد، چه مثبت و چه منفی، بیانگر این است که ماده به ترتیب خاصیت اکسیدکنندگی یا کاهندگی بیشتری دارد.
اندازه گیری ORP آب امری ضروری است زیرا به کمک آن میتوان واکنشهایی که در آب اتفاق میافتد را تعیین و بر فرایندهای مختلف نظارت نمود. یکی از مهمترین کاربردهای اندازهگیری ORP در فرایندهای ضدعفونی با کلر، ازن و برم است زیرا مواد ضدعفونی کننده، اکسیدکنندههایی قوی میباشند؛ بنابراین شاخص ORP را میتوان به عنوان شاخص فعالیت ضدعفونی کننده نیز در نظر گرفت. اندازه گیری سطوح اُ آر پی به جز استریل کردن، برای کاربردهای دیگری مانند پرورش ماهی، برجهای خنک کننده، استخرهای شنا و جکوزی نیز مهم و ضروری است.
برای اندازه گیری ORP از دستگاه ORPمتر استفاده میشود و خروجی این دستگاه نیز عددی مثبت یا منفی بر حسب میلیولت است. دستگاه ORP متر دارای یک حسگر الکتروشیمیایی به نام سنسور ORP یا REDOX است که ORP را اندازه گیری میکند. این سنسور از دو الکترود شامل الکترود اندازه گیری و الکترود مرجع تشکیل شده است. دستگاه با اندازه گیری اختلاف پتانسیل این دو الکترود، میزان ORP را بر حسب میلیولت گزارش میکند. الکترود اندازه گیری عمدتا از یک فلز نجیب یا بی اثر مانند پلاتین یا طلا ساخته میشود که در برابر واکنشهای شیمیایی مقاومت بالایی دارد. الکترود مرجع نیز عمدتا مشابه الکترود مرجع pHمتر است و از یک سیم نقره/نقره کلرید در محلول الکترولیت کلرید پتاسیم تشکیل شده است. باید اشاره داشت که یک سنسور اندازه گیری ORP میتواند علاوه بر الکترود ORP/رفرنس (شکل الف)، با الکترود اندازه گیری pH نیز ترکیب شود و یک دستگاه pH/ORP متر را تشکیل دهد (شکل ب).

شکل الف-الکترود ORP/رفرنس شکل ب- الکترود ORP/رفرنس همراه با الکترود اندازهگیری pH
باید توجه داشت که اندازه گیری ارائه شده توسط ORPمتردر واقع غلظت ORP در آب را نشان نمیدهد؛ بلکه این اندازه گیری همانند pH، برای نشان دادن فعالیت در آب طراحی شده است. برای نمونه در طول فرایند ضدعفونی سازی میتوان با استفاده از یک ORPمتر تعیین کرد که عامل ضدعفونی کننده، آلایندهها را به درستی تجزیه میکند یا خیر. البته باید به این نکته نیز دقت داشت که در صورتی که تنها یک گونه فعال در آب وجود داشته باشد، سنسور ORP میتواند غلظت را قرائت کند. برای مثال زمانی که آب استخر بسیار تمیز است و تنها از کلر تشکیل شده، مقداری که ORPمتر نشان میدهد، همان غلظت ORP آب استخر است.

اکسیژن محلول (DO)
اکسیژن محلول یا Dissolved Oxygen که با نام DO نیز شناخته میشود، به اکسیژن آزاد و غیر ترکیبی موجود در آب یا مایعات دیگر اطلاق میگردد؛ به بیان دیگر DO اکسیژن مولکولی گازی به شکل O2 است که این مولکولهای اکسیژنها به هیچ عنصر دیگری پیوند ندارند و در آب، آزاد و محلول هستند. DO از طریق اتمسفر یا در اثر فتوسنتز گیاهان، به آب وارد میشود. میزان اکسیژن محلول در آب مهم است زیرا میتواند بر بسیاری از واکنشهای شیمیایی اثر بگذارد. همچنین میزان این اکسیژن برای حیات موجودات زنده داخل آب بسیار ضروری است زیرا تمامی موجودات آبزی برای ادامه زندگی به این اکسیژن نیازمندند و در صورتی که سطح DO آب از حد مشخصی کمتر گردد، این موجودات دچار خفگی و مرگ میشوند.
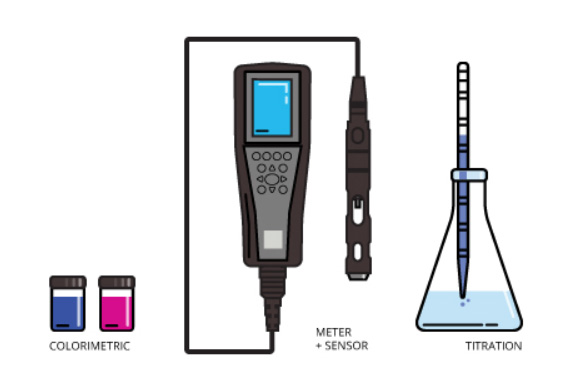
اکسیژن محلول را عموما با واحدهای میلیگرم بر لیتر (mg/L) یا درصد اشباع (DO%) گزارش میکنند. روشهای مختلفی برای اندازه گیری DO یا اکسیژن محلول وجود دارد که از جمله آنها میتوان به استفاده از سنسورهای الکتروشیمیایی، سنسورهای نوری، تیتراسیون و روش کالریمتری (رنگ سنجی) اشاره داشت. با توجه به اهمیت و کاربرد بالای سنسورهای الکتروشیمیایی و سنسورهای نوری در اندازه گیری DO، در ادامه توضیحاتی در رابطه با هرکدام از این روشها ارائه خواهد شد.
سنسورهای الکتروشیمیایی
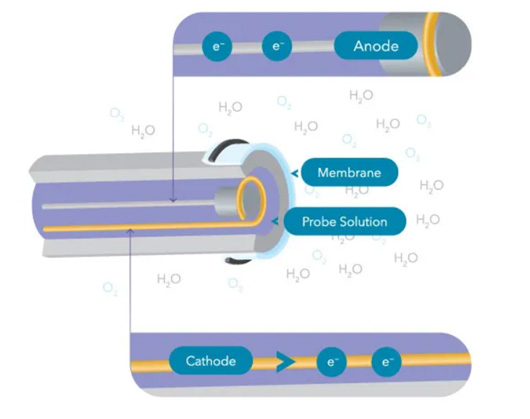
سنسورهای الکتروشیمیایی که خود به دو دسته پولاروگرافی (polarographic) و گالوانیک (galvanic) تقسیم بندی میشوند، میتوانند میزان DO آب را به سرعت محاسبه کنند. هر دو نوع این سنسورهای الکتروشیمیایی از دو الکترود پولاریزه شده (یک آند و یک کاتد) در درون یک محلول الکترولیت استفاده میکنند. الکترودها و محلول الکترولیت توسط یک غشای نازک و نیمه تراوا از نمونه جدا میشوند. در هنگام اندازهگیری، اکسیژن محلول با سرعتی متناسب با فشار اکسیژن در آب، در سراسر غشا پخش میشود، سپس اکسیژن محلول در کاتد کاهش مییابد و مصرف میشود. این واکنش منجر به تولید جریان الکتریکی میشود که به طور مستقیم با غلظت اکسیژن در آب متناسب است. این جریان توسط یونهای موجود در الکترولیت حمل میشود و از کاتد به آند میرسد و در نتیجه با انجام یک سری محاسبات، مقدار DO مشخص و گزارش میشود.
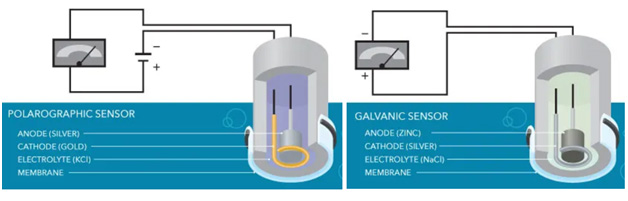
سنسورهای الکتروشیمیایی پولاروگرافی دارای یک آند از جنس نقره و کاتد از جنس طلا هستند. این مواد نیاز دارند که پروبشان قبل از استفاده گرم یا قطبی شود (این امر 10 دقیقه طول میکشد). از این رو، این سنسورها نسبت به سنسورهای گالوانیکی عمر نسبتا طولانیتری دارند زیرا همیشه روشن نیستند. درحالی که سنسورهای گالوانیک آندشان از جنس نقره و کاتدشان از جنس طلا است. این مواد امکان قطبی شدن مداوم سنسورها را به آنها میدهند؛ در نتیجه نیاز به زمان گرم سازی ندارند. اما باید توجه داشت که این روشن بودن همیشگی از عمر مفید این سنسورها میکاهد و این سنسورها عمدتا طول عمر کمتری نسبت به سنسورهای پولاروگرافی دارند.
سنسورهای نوری
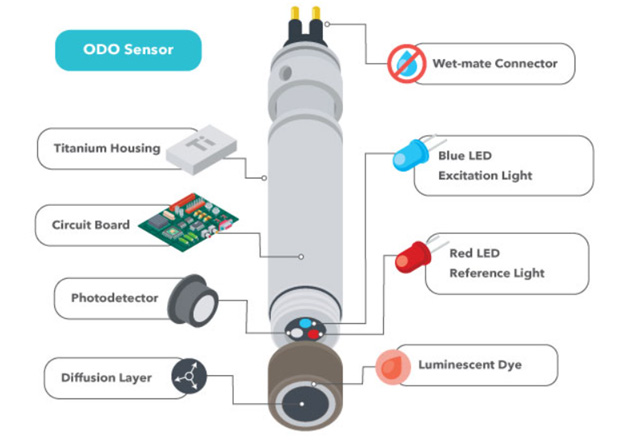
سنسورهای نوری برهمکنش بین اکسیژن و برخی از رنگهای درخشان را اندازه گیری میکنند. این رنگها، هنگام قرارگیری در معرض نور آبی، برانگیخته میشوند (الکترونها انرژی میگیرند)، سپس با بازگشت الکترونها به سطح انرژی طبیعی خود، نور ساطع میشود. هنگامی که اکسیژن محلول در آب وجود داشته باشد، طول موجهای برگشتی به دلیل واکنش مولکول اکسیژن با رنگ، محدود میشوند یا تغییر میکنند. اثر اندازه گیری شده با فشار جزئی اکسیژن نسبت معکوس دارد. گاه به سنسورهای نوری، سنسورهای فلورسنت نیز میگویند که این اصطلاح از نظر فنی غلط است زیرا این سنسورها از خود نور آبی ساطع میکنند، نه نور فرابنفش.
به طورکلی یک سنسور نوری DO از یک غشای نیمه تراوا، عنصر حسگر، دیود ساطع کننده نور (LED) و ردیاب نوری تشکیل شده است. عنصر حسگر حاوی یک رنگ درخشان میباشد که در سل-ژل یا یک ماتریس دیگر تثبیت شده است. این رنگ هنگام قرارگیری در معرض نور ساطع شده از LED، واکنش میدهد. برخی از حسگرها برای اطمینان از دقت اندازه گیری DO، نور قرمز را نیز به عنوان مرجع ساطع میکنند. شدت و طول عمر درخشندگی رنگ، هنگام قرار گرفتن در معرض نور آبی، به میزان اکسیژن محلول موجود در آب بستگی دارد. به عبارت دیگر، اکسیژن با عبور از غشا، با رنگ واکنش میدهد و شدت و طول عمر درخشش را محدود میکند. شدت یا طول عمر درخشش برگشتی توسط یک ردیاب نوری اندازه گیری میگردد و این مقادیر برای محاسبه اکسیژن محلول به کار گرفته میشوند.